Бинерните химични съединения на елементите с елемента водород се наричат водородни съединения (хидриди). Химичните съединения на въглерода с водорода се наричат въглеводороди и спадат към групата на органичните съединения, които също могат да се разглеждат в някои аспекти като водородни съединения.
Водородните съединения биват: йонни, ковалентни и металообразни. В тази публикация има приложени две таблици на елементите и съответстващите им хидриди, които обаче имат известни различия в класификацията им. Те са достатъчно добри от образователна гледна точка, но за по-задълбочено детайлно запознаване със съответния елемент и хидрид, препоръчваме на читателите да потърсят по-тясно специализирана литература.
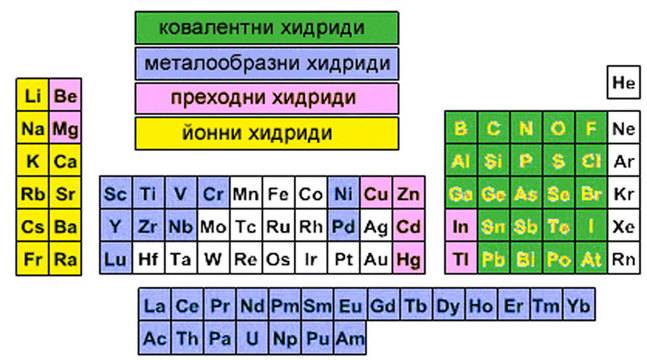
Периодичната система на химичните елементи групирани (в различни цветове) според вида хидриди, които образуват
Йонни хидриди
Йонните водородни съединения носят общото название хидриди, което повечето автори ползват и за всички останали видове. Те се образуват от s-елементи с метален характер (без Be и Mg) и водород, като се характеризират с йонна кристална решетка и се наричат още солеобразни.
При обикновени условия хидридите са твърди кристални вещества с висока температура на топене, макар че повечето се разлагат при нагряване в отсъствие на въздух още преди да се стопят. Стопилките им провеждат електричен ток, което е доказателство за йонния им строеж.
Водородът в йонните хидриди е в -1-ва степен на окисление, което го прави добър редуктор и с лекота отдава електрони, което пък определя добрите редукционни свойства на йонните водородни съединения:
Na+H– + H+Cl– → Na+Cl– + H2
При взаимодействие на йонните хидриди с вода се получават основи и се отделя водород, а при изгарянето им в кислородна среда се образува съответният оксид и вода:
Na+H– + H2О → {Na+ + OH–} + H2↑
2NaH + O2 → Na2O+ H2O↑
Ковалентни хидриди
Ковалентните водородни съединения имат молекулен строеж и се образуват от p-елементите (IVA – VIIA групи) и водорода. Някои s-елементи (Be, Mg, B, Al, Ga) дават хидридни асоциати – полимерни водородни съединения също с ковалентни връзки.
Степентта на полярност на ковалентната връзка при всички зависи от електроотрицателността на съответния p-елемент. При обикновени условия повечето ковалентни водородни съединения са летливи течности или газове, но въглеводородите с дълги молекулни вериги са в твърдо агрегатно състояние.
Втори вариант на горната ПС
Някои ковалентни водородни съединения създават междумолекулни водородни връзки, което повишава температурите им на кипене. Пример за такива са водата, амонякът и флуороводородът.
При взаимодействие и разтваряне на ковалентните хидриди с вода, получените продукти се отнасят различно. Хлороводородът (HCl) дава солна киселина (HCl), амонякът (NH3) образува амониева основа (NH4OH), а някои въобще не реагират.
Металообразни хидриди
Съединенията на d-елементите и f-елементите (лантаноидите и актиноидите) с водорода се наричат металообразни водородни съединения и имат метална решетка. Тези хидриди нямат конкретна химична формула с точно определени съотношения между водорода и другият елемент, макар че в практиката се ползват такива формули.
Простите вещества на металите в горепосочените групи имат голям афинитет към водорода и на практика го включват в собствената си кристална решетка в големи нестехиометрични количества. Металната решетка се запазва, химичната връзка също запазва металния си характер и затова тези водородни съединения се наричат металообразни. Водородът в тях може да бъде атомен (Н), молекулен (H2) или в йонно състояние (H+, H–).
Металообразните хидриди са с висока топло- и електропроводимост. Те са праховидни сиво-черни вещества с метален блясък и добри каталитични свойства.
Получаване
Хидриди се получават посредством: директно взаимодействие на водород със съответният химичен елемент
2Na + H2 → 2NaH
2U + 3H2 → 2UH3
Na + Al + 2H2 → Na[AlH4]
косвено
CaS + H2SO4 → H2S + CaSO4
TiCl2 + MgH2 → TiH2 + MgCl2
Приложение
никел метал хидридни батерии
Хидридите на натрия, лития и калция се използват като редуктори в химическите и фармацевтичните производства. Етерен разтвор на Li[AlH4] се употребява в процесите на редукция на карбонилни производни до алкохоли.
Очевиден е фактът, че хидридите са добър източник на водород за химичните синтези, но редукционните свойства на металообразните се използват в праховата металургия и за получаването на чисти метали като волфрам, молибден и др. Водородните съединения участват и в производството на земеделски торове, инсектициди, лекарствени препарати, батерии за мобилни устройства и пр.
Директната употреба на хидриди също е често срещана практика. Някои от водородните съединения на бора (бораните) и хидразинът (N2H4) се използват в ракетостроенето като ракетни горива. Може би най-важното от всички водородни съединения е водата, затова тя е разгледана в отделна публикация. Нейните употреба и значение както за живота от биологична гледна точка, така и за индустрията са не просто огромни, а незаменими и определящи във всеки един аспект.
Сходни Публикации