Електролиза е явление, което в своята същност представлява окислително-редукционни процеси, протичащи в стопилки или в разтвори на електролити под действието на постоянен електричен ток.
Електролиза в стопилка
За разлика от класическите окислително-редукционни процеси, електролизата не протича спонтанно, а задължително изисква наличието на външен източник на електричен ток. Ако два въглеродни електрода се потопят в стопилка на натриев хлорид (NaCl), а в другия си край са свързани за галваничен елемент (батерия), в стопилката се наблюдава ориентиране на йоните към електродите. Отрицателно заредените хлорни йони се насочват към положителния електрод (анод) и затова се наричат аниони. Положително заредените натриеви йони се ориентират към отрицателния електрод (катод) и затова се наричат катиони.
дисоциация: NaCl → Na+ + Cl–
процес на катода: Na+ + e– → Na процес на анода: Cl– – e– → Cl → Cl2
За да протече процесът електролиза е необходимо да се наруши равновесното състояние на електродите. Тази е причината те да се свързват към външен източник на постоянен електричен ток. Стойностите на електродните потенциали се изменят и се наблюдава електрична поляризация. При протичането на електричество, катодът действа като редуктор и отдава електрони, а анодът приема електрони и действа като окислител. Много подобни са процесите протичащи при електролиза в разтвор на соли.
Електролиза в разтвор
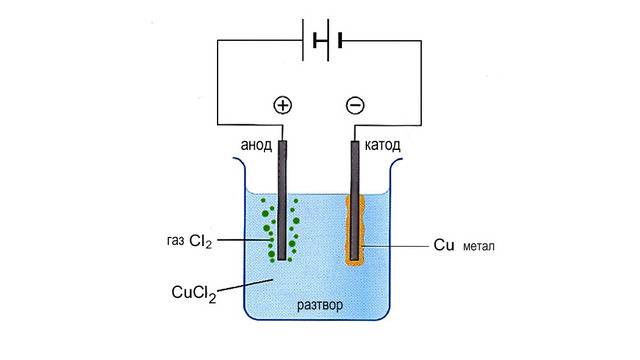
Ако два въглеродни електрода се потопят в разтвор на меден дихлорид (CuCl2 ), при пропускане на постоянен електричен ток, на катода се натрупва метална (елементарна) мед, а при анода се отделя газообразен молекулен хлор.
дисоциация: CuCl2 → Cu2+ + 2 Cl–
дисоциация на водата: HOH → H+ + OH–
процес на катода: Cu2+ + 2e– → Cu процес на анода: 2Cl– – 2e– → 2Cl → Cl2
Електролиза на меден дихлорид
Към катода се отправят и двата катиона – на медта и на водорода, но тъй като атомите и йоните на медта са по-слаби редуктори и следователно по-силни окислители, тя приема електрон по-лесно отколкото водородът. Обратното се случва на анода, тъй като хлорните йони са по-слаби окислители от хидроксилните, ерго по-силни редуктори, хлорният анион отдава електрон, за да се получи атом хлор. Атомите хлор са силно реактивоспособни (като всички други атоми) и се свързват в хлорна молекула газ. Афинитетът на различните елементи към електроните може да се прецени по Реда на относителната им активност, който е обяснен по-подробно в публикацията Окислително-редукционни процеси в раздел Химия.
Почти всички химични елементи могат да се проявяват като окислители и редуктори! Колкото по-силен окислител е един елемент, толкова по-слаб редуктор е той и обратното.
Ако се разгледа втори пример на електролиза с разтвор на (ди) натриев сулфат ( Na2SO4), тогава към електродите се насочват пак всички йони в разтвора, но в електролизните процеси участват хидроксилните аниони (ОН-) и водородните катиони (Н+). Първите са по-силни редуктори и по-лесно отдават електрон от сулфатните аниони. Водородните са по-силни окислители от натриевите и ще приемат електрони. При електролизата ще се отделят молекулен водород и кислород – газове.
Електролиза – количествена характеристика
През 1832 година английският физик Майкъл Фарадей установил, че масите m на отделящите се на електродите вещества са правопропорционални на големината на електричния ток, който протича през стопилката или разтвора на електролита. Този извод лежи в основата на първия закон за електролиза. Вторият закон за електролиза декларира, че когато през разтвор или стопилка на различни електролити се пропусне еднакъв по големина електрически ток за идентичен отрязък от време, на електродите се натрупва или отделя маса вещество пропорционална на еквивалентната моларна маса Мeq. Последната е равна на моларната маса M върху числото z на еквивалентност (М/z). Двата закона могат да се обединят в един общ закон на Фарадей изразен със следното уравнение:
m=k.I.t, където
I е големината на електрическия ток в ампери, t е времето в секунди, а k е електрохимичен еквивалент:
k=(1/F).(M/z), където F е константа на Фарадей;
Приложение на електролизата за индустриални цели
Производство на хлор, водород и натриева основа – хлоралкална електролиза наразтвор от натриев хлорид ( готварска сол ). При процеса се отделят двата газа (хлор и водород ) и в разтвора остава дисоцииран натриев хидроксид ( натриева основа ).
Пречистване на метали – процесът електролиза може да се използва пречистване на мед или цинк. Цинков оксид разтворен в разредена сярна киселина дава цинков сулфат, при чиято електролиза на катода се отделя метален цинк вместо газообразен водород. Това е факт заради голямото свръхнапрежение на редукция на водородните катиони. При пречистването на техническата мед, електролизата пак протича в съд със сярна киселина и меден сулфат, но анодът в случая е съставен от самата техническа мед. Медните йони мигрират към катода и там се отлагат като чиста мед, а онечистванията остават в съда с разтвора.
Получаване на метали – при електролиза на стопилки на соли могат да се получават алкални и алкалоземни метали.
Галванотехника и метални покрития – за да се съдаде тънко, равномерно и плътно метално покритие върху даден метален предмет, той се използва като катод и чрез електролиза на него се отлагат йоните на метала, който служи за покритие. Процесът се нарича галванизация, а всичко свързано с него е обект на галванотехниката. Галваничните (метални) покрития най-често имат антикорозионна функция и за целта се използват метали като хром, цинк, никел и др. Галванизация може да се приложи и при процесите на позлатяване или посребряване на даден метален предмет на изкуството.
Получаване на кислород и водород – при електролиза на вода;